MAINRITSEG
Introduction
Etude prospective, multicentrique, contrôlée, en double-aveugle, randomisée, de supériorité, avec double-placebo, comparant en traitement d'entretien le rituximab à un traitement par azathioprine au cours de la granulomatose éosinophilique avec polyangéite (Churg-Strauss).
Objectif
Déterminer l’efficacité d’un régime thérapeutique basé sur le rituximab pour maintenir la rémission chez les patients atteints de GEPA (Churg-Strauss).
Population concernée
Patients atteints d’une GEPA (Churg-Strauss), en rémission, sous corticoïdes à dose stable depuis 30 jours.
L’étude MAINRITSEG s’adresse à :
- tous les malades inclus dans le protocole REOVAS en rémission clinique lors de l’évaluation du critère de jugement principal à la visite M12 et quelle que soit la dose de corticoïdes
- ainsi qu’aux patients en dehors de REOVAS dans les 30-360 jours suivant l’obtention d’une rémission de la vascularite (BVAS=0) obtenue avec un régime d’induction incluant celui utilisé dans l’essai REOVAS :
- soit corticoïdes seuls
- ou en association avec du CYC IV (dose cumulée de 5-10 g)
- ou du rituximab (1 g x 2, administré à J1 et J15 ou 375 mg/m2 4 semaines de suite).
Lors de sa visite M9 dans REOVAS, le patient recevra l’information concernant l’étude MAINRITSEG, afin qu’il dispose d’un délai de réflexion suffisant.
La visite du 12ème mois de REOVAS peut coïncider avec l’inclusion dans MAINRITSEG et la première perfusion de MAINRITSEG, mais un délai de 30 jours est autorisé après la visite M12 pour randomiser le patient.
Déroulement de l'étude
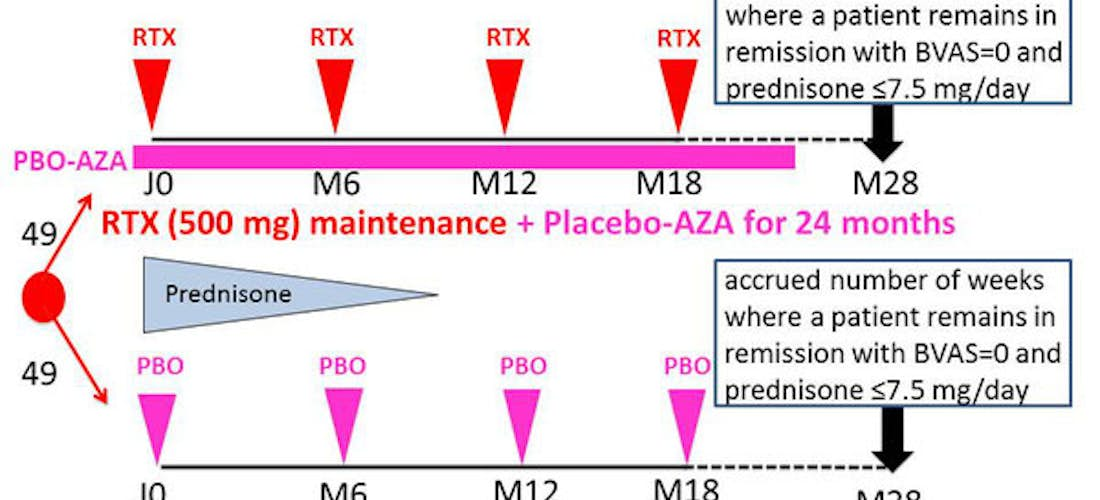
Les patients seront randomisés, avec un ratio 1/1 pour recevoir, en plus d’un schéma conventionnel de décroissance arrêt de la corticothérapie :
- Traitement standard : administration d’azathioprine par voie orale (2 mg/kg/jour) pendant 24 mois. Ce groupe contrôle recevra le traitement standard par voie orale et 4 perfusions de placebo-rituximab (tous les 6 mois pendant 18 mois).
- Traitement expérimental : perfusions d’une dose fixe de 500 mg de rituximab tous les 6 mois pendant 18 mois (4 perfusions). Ce groupe expérimental recevra le rituximab par voie IV et le placebo-d’azathioprine par voie orale pendant 24 mois.
Critères de Jugement
Durée totale de rémission, à savoir le nombre cumulé de semaines, au cours de la période de l'étude de 28 mois, où un patient reste en rémission complète définie par un BVAS = 0 et une posologie de prednisone ≤7.5 mg/jour.
Durée de l'étude :
Durée totale de l’étude : 52 mois
Durée d’inclusion : 24 mois
Suivi par patient : 28 mois
L'ensemble des patients ont été inclus dans cette étude dont le suivi est encore en cours.
Les résultats devraient être connus au cours du 2ème semestre 2024.
Fichiers supplémentaires





Objectif de ce protocole
Déterminer l’efficacité d’un régime thérapeutique basé sur le rituximab pour maintenir la rémission chez les patients atteints de GEPA (Churg-Strauss).
Coordonnées des responsables :
Investigateur coordonnateur :
Dr Xavier Puéchal
E-mail : xavier.puechal@aphp.fr
Tel : 01 58 41 29 71 / Fax : 01 58 41 29 68
Responsable scientifique :
Pr Benjamin Terrier
E-mail : benjamin.terrier@aphp.fr
Tel : 01 58 41 14 61 / Fax : 01 58 41 14 50
Chef de Projet : Adèle Bellino
Tel : 01 58 41 28 99/ Fax : 01 58 41 11 83
E-mail : adele.bellino@aphp.fr









