Granulomatose avec polyangéite (Wegener)
Un cours enregistré est également disponible en cliquant ici pour la présentation générale, et ici sur les immunothérapies ciblées au cours de la GPA.
La granulomatose avec polyangéite (Wegener) est une vascularite nécrosante associant une inflammation de la paroi vasculaire et une granulomatose péri- et extravasculaire. Sur le plan clinique, la granulomatose avec polyangéite (GPA) se caractérise dans sa forme complète, par des signes ORL, une atteinte pulmonaire et une atteinte rénale. D'autres manifestations systémiques de vascularite peuvent également être présentes. La GPA est une maladie grave, mortelle en l'absence de traitement. Toutefois les thérapeutiques actuelles permettent de contrôler l'évolution, de la guérir dans la plupart des cas, même si les rechutes restent fréquentes.
PATHOGENIE DE LA MALADIE
Les neutrophiles sont les acteurs « clés » dans cette pathologie car ils produisent l’autoantigène, la protéinase 3, et leur régulation est altérée chez les patients (1). Les patients atteints de GPA possèdent des auto-anticorps dirigés contre la protéinase 3 localisée dans les neutrophiles. Ces cellules recrutées au site de l’inflammation lors d’un dommage tissulaire ou d’une infection ont un rôle crucial dans la défense contre les microbes mais peuvent, lorsqu’ils persistent au site de l’inflammation, détruire les tissus. L’autoantigène protéinase 3 exprimé à la membrane des neutrophiles apoptotiques perturbe leur élimination par les macrophages (Cliché 1). L’expression de PR3 à la membrane des neutrophiles activés prévient la résolution de l’inflammation et est un élément capital dans la pathogénie de la GPA. Alors que la phagocytose d’une cellule apoptotique en condition physiologique a un effet anti-inflammatoire, la protéinase 3 est perçue comme un signal de danger par le macrophage, déclenchant une réponse d’alerte au système immunitaire et favorisant une réponse auto-immune. Cet effet subversif de la protéinase 3 va alors favoriser la mise en place d’une réponse auto-immune, en particulier en alertant les cellules dendritiques plasmacytoïdes qui, à leur tour, vont totalement abolir la génération de lymphocytes CD4+ régulateurs et, au contraire promouvoir l’émergence de lymphocytes activés ayant un profil Th9/Th2. Selon le stade de la maladie, le rôle respectif de la granulomatose et de la vascularite varie. Certaines formes, souvent plus précoces sont granulomateuses d’autres, plus tardives sont à prédominance vasculaire inflammatoire.
ANATOMIE PATHOLOGIQUE
La GPA comprend, sur le plan anatomopathologique, une nécrose ischémique en "carte de géographie" qui se traduit par la formation d'abcès amicrobiens et une granulomatose polymorphe qui associe des polynucléaires, des lymphocytes et des cellules géantes multinucléées.
La vascularite touche des vaisseaux de petit calibre (artérioles, capillaires, et parfois veinules) et plus rarement de moyen calibre (Figure 1 et Figures 4). La vascularite est souvent difficile à individualiser en raison de la prédominance des granulomes. Le granulome n’est pas spécifique, comportant des cellules géantes.
Le diagnostic histologique peut être obtenu par des biopsies orientées. Comme toujours, il faut biopsier les sites intéressés cliniquement et prélever sans faire courir de risque au malade. Le souhait d’obtenir une preuve histologique est parfois contrebalancé par la sécurité des patients.
Quels sites faut-il biopsier ?
- la biopsie pulmonaire peut concerner un nodule ou le parenchyme d’un malade ayant présenté une hémorragie alvéolaire. La biopsie des nodules montre le granulome palissadique au sein duquel les vaisseaux présentent une vascularite artériolaire. En cas d’hémorragie alvéolaire, on trouve essentiellement une capillarite. La biopsie pulmonaire est orientée par vidéoscopie. La thoracotomie est un geste lourd, dont la mortalité et la morbidité ne sont pas négligeables. On peut donc discuter l’opportunité d’un tel geste, notamment chez un malade qui présente un tableau clinique très évocateur et des ANCA de type cytoplasmique anti-PR3 en ELISA (Figure 7).
- La biopsie naso-sinusienne est simple à réaliser mais nécessite une bonne technique, avec des prélèvements nombreux, en zone granulomateuse, plus qu’en zone de nécrose. Sa rentabilité est plus faible que la biopsie pulmonaire.
- La biopsie rénale. Elle doit être faite dès qu’il y a des anomalies du sédiment urinaire, une protéinurie et/ou une altération, même modérée de la fonction rénale. Elle permet de rechercher la glomérulonéphrite extra-capillaire et les signes directs de la vascularite. Elle apprécie le degré de l’atteinte parenchymateuse et des lésions fibreuses déjà constituées ainsi qu’une éventuelle composante de nécrose tubulaire associée, permettant ainsi de donner des éléments pronostiques de récupération.
- La biopsie musculaire ou neuro-musculaire : utile et très rentable lorsque le malade présente une neuropathie périphérique.
- La biopsie de l’artère temporale est de bonne rentabilité chez les malades qui ont des céphalées. Sa pratique systématique n’est pas validée.
FORMES GENERALISEES ET FORMES LOCALISEES
Au cours de la GPA, on distingue :
- les formes généralisées/diffuses caractérisées par :
- une atteinte rénale ;
- et/ou une hémorragie alvéolaire importante et évolutive ;
- et/ou par l’atteinte d’un ou de plusieurs autres organes, en particulier s’il s’agit d’un organe vital, avec des signes généraux ;
- les formes limitées/localisées, principalement respiratoires (ORL et/ou pulmonaire sans hémorragie alvéolaire), sans atteinte rénale, mais parfois aussi cutanées, sans altération de l’état général et qui n’engagent pas le pronostic vital (30 % des cas de GPA environ).
Le passage d’une forme localisée/limitée à une forme généralisée/diffuse, et vice versa, est possible au cours de l’évolution de la maladie.
SIGNES CLINIQUES
Il s'agit d'une maladie rare et on évalue sa prévalence à 3/100.000 habitants. Il existe un gradient nord-sud, avec une plus grande fréquence de vascularite ANCA+ dans les pays nordiques. La GPA intéresse les deux sexes. L'âge moyen de survenue est de 45 ans. Des formes on été décrites chez le sujet très âgé et chez l'enfant. Les principales manifestations cliniques sont résumées dans le Tableau I (2-7).
Les manifestations ORL
Les signes ORL sont souvent ceux qui révèlent la maladie. Ils peuvent persister plusieurs mois et rester méconnus jusqu’à ce que de nouvelles manifestations surviennent. Une sinusite, une rhinite traînante sont habituelles (Cliché 2). Le scanner peut montrer une destruction osseuse. Il est indispensable au diagnostic et à l’évaluation des lésions. Une sinusite, des épistaxis, une surdité sont aussi décrits. Une sténose sous glottique est plus rare. Enfin la région orbitaire peut être intéressée secondairement avec un tableau initial de pseudotumeur inflammatoire, d’exophtalmie unilatérale.
Les manifestations pulmonaires
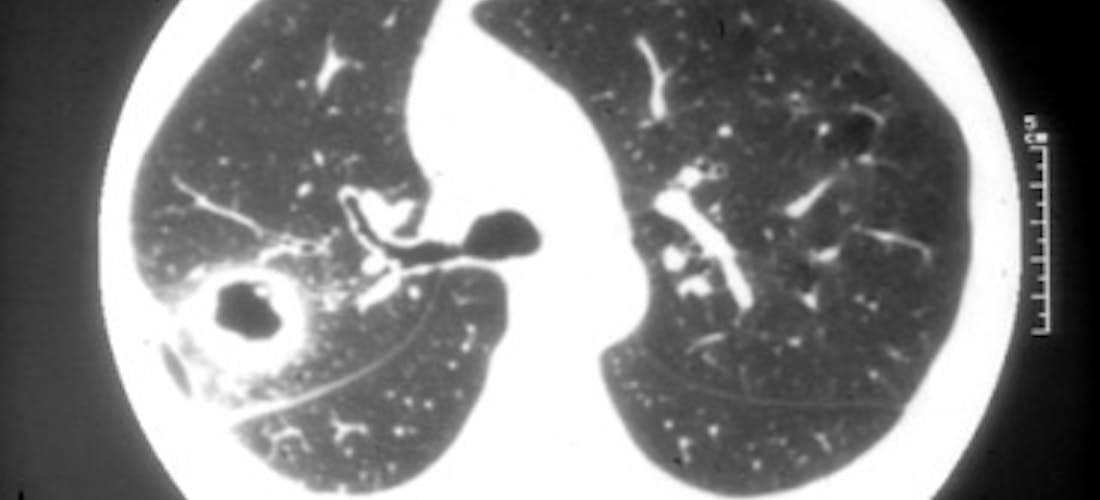
Les signes d'appel pulmonaires sont non spécifiques : toux, dyspnée, douleurs thoraciques, hémoptysies. La radiographie du thorax et le scanner montrent des nodules, unis ou bilatéraux, uniques ou multiples, excavés dans la moitié des cas (Cliché 3 et Cliché 4). Ils ont souvent une paroi épaisse. Ils peuvent être très nombreux mais, en général, inférieurs à 10. Leur survenue est parallèle à la progression de la maladie. Des infiltrats pulmonaires uni ou bilatéraux, peuvent également être observés. Un épanchement pleural s'y associe rarement. La fibroscopie bronchique peut mettre en évidence des sténoses (Cliché 5), conséquence de la granulomatose. Elles sont souvent très difficiles à traiter. On peut également mettre en évidence des masses pulmonaires granulomateuses pseudo-tumorales.
L'hémorragie alvéolaire est une des manifestations pulmonaires potentiellement graves de la GPA (Cliché 6 et Cliché 7). Le diagnostic est confirmé au lavage alvéolaire lorsqu’il revient uniformément rouge ou rosé et/ou si le lavage revient clair lorsque la coloration de Perls met en évidence plus de 30 % de sidérophages (macrophages positifs) et/ou le score de Golde est supérieur à 100. Un syndrome de détresse respiratoire peut la compliquer. L'association des signes pulmonaires et d'une insuffisance rénale définit le syndrome pneumo-rénal dont la survenue évoque un certain nombre de vascularites dont la GPA.
Les manifestations rénales sont univoques.
Il s'agit d'une insuffisance rénale rapidement progressive avec histologiquement une glomérulonéphrite extra-capillaire à croissants (Cliché 8). L'immunofluorescence est négative.
L'atteinte rénale peut conduire à une insuffisance rénale terminale. Son dépistage est essentiel. La recherche de l’hématurie et de la protéinurie est indispensable au moment du diagnostic et lors de chaque consultation de surveillance. Seule la biopsie rénale permet de faire le diagnostic de glomérulonéphrite extra-capillaire. Non dépistée, ni traitée à temps, elle évolue vers une insuffisance rénale, sévère. Il est important de traiter vite car une réversibilité partielle ou totale peut être obtenue sous traitement spécifique, corticoïde et immunosuppresseur.
L’insuffisance rénale peut aussi avoir d’autres causes qu’il ne faut pas méconnaître : sténose urétérale responsable d’une hydronéphrose uni- ou bilatérale.
Chez un patient traité, l’insuffisance rénale peut aussi avoir une cause iatrogène.
Autres manifestations
Les autres manifestations cliniques sont celles de l'on observe dans les autres vascularites (voir chapitres précédents). Nous insisterons toutefois sur la possibilité de manifestations neurologiques périphériques qui ne sont pas spécifiques de la maladie, des signes cutanés traduisant l'atteinte des vaisseaux de petit calibre. Il peut aussi y avoir des manifestations articulaires et/ou musculaires. Une forte incidence de complications thrombo-emboliques a été décrite dans les premiers mois de la maladie en pleine phase d’activité.
EXAMENS BIOLOGIQUES ET IMMUNOLOGIQUES
La GPA s'accompagne d'un élément immunologique essentiel au diagnostic et peut-être au suivi de la maladie. Il s'agit de la présence d'ANCA de type cytoplasmique diffus. Ils sont présents dans environ 90 % des formes diffuses et dans 50 % des formes localisées de la maladie. Il s'agit d'un anticorps dirigé contre la protéinase 3 dans 75 % des cas (7) et beaucoup plus rarement contre la myéloperoxydase (Figure 7). L'anticorps isolé au cours de la GPA est très spécifique et a donc une importante valeur diagnostique. Dans certaines conditions, sa présence peut suffire, associée à une clinique évocatrice. Par contre, il ne permet pas d'éviter la biopsie rénale qui permet, non seulement d'établir un diagnostic mais aussi de donner des renseignements sur le pronostic de l'atteinte rénale en montrant le caractère récent ou ancien des lésions, ainsi que leur étendue et leur degré de fibrose irréversible déjà constituée.
La persistance d’ANCA anti-PR3 sous traitement est un facteur prédictif de la survenue de rechute. Leur disparition ne permet cependant pas de prédire l'absence de rechute. Une augmentation significative du taux des cANCA PR3 fait craindre la survenue d’une rechute (8). Mais deux études prospectives dans la GPA ont montré qu’en cas d’augmentation du taux des ANCA, 29 à 60 % des patients ne rechutent pas à 1 an (9,10). Cela veut dire que si l’on avait traité, ce serait 29 à 60 % de patients en trop qui auraient été traités. On ne peut donc utiliser isolément le taux des ANCA comme élément d'adaptation thérapeutique. Une augmentation du titre des ANCA incite donc à rapprocher la surveillance mais pas à majorer le traitement.
ÉVOLUTION ET PRONOSTIC
Non traitée, la GPA avait une mortalité à 1 an d’environ 70 %. Sous traitement, une rémission est obtenue dans plus de 80 % des cas. Les rechutes sont fréquentes, quelque soient leurs caractéristiques. Elles surviennent dans plus de 50 % des cas. Malgré cela, le taux de survie atteint maintenant 75 % à 10 ans (11).
Le pronostic de la GPA est lié à divers facteurs (8) : l’âge élevé, l’insuffisance rénale sont des facteurs de mauvais pronostic. L’atteinte ORL est associée à un meilleur pronostic. Pour aider le clinicien à proposer la thérapeutique la plus appropriée et éviter notamment le sur-traitement au cours de la PAN, de la PAM et de la GEPA, nous avons proposé un score pronostique FFS (Five Factor Score) (12) qui a été actualisé (13). Ce nouveau score s’applique aussi à la GPA (13). Il tient compte des manifestations associées à une surmortalité à savoir l’existence d’un âge supérieur à 65 ans, d'une cardiomyopathie spécifique, de manifestations gastro-intestinales, d’une insuffisance rénale définie par une créatininémie stabilisée supérieure à 150 µmol/l et de l’absence de manifestations ORL (Tableau II) (13). En l’absence de ces 5 facteurs pronostiques défavorables, le FFS est nul et la mortalité est de 9 % à 5 ans (13). Lorsqu’un facteur est présent, le FFS est de 1 et la mortalité est de 21 % à 5 ans. Lorsque plus d’un facteur est présent, la mortalité est de 40 %. Néanmoins, dans la GPA, le FFS renseigne sur le pronostic mais ne conditionne pas la thérapeutique, comme pour la périartérite noueuse, la polyangéite microscopique ou la granulomatose éosinophilique avec polyangéite (Churg-Strauss) (14).
Au diagnostic, les facteurs associés à une rechute sont la présence d’ANCA PR3, une atteinte cardiaque et une clairance de la créatinine > 60 ml/mn (8). La persistance d’ANCA est également associée à une augmentation du risque de rechute (15-17).
TRAITEMENT DE LA GRANULOMATOSE AVEC POLYANGEITE
Le traitement de la GPA repose sur l'association de corticoïdes et d’immunosuppresseurs (Figure 8) (14). Dans les formes systémiques, il a été démontré que les corticoïdes, lorsqu'ils sont prescrits seuls, ne permettent pas d'obtenir et de maintenir la rémission (18). Les premières observations de rémission prolongée et de guérison ont été obtenues lorsque le cyclophosphamide était associé à la corticothérapie (2). Cette combinaison était considérée comme étant le "gold standard". Néanmoins, le devenir des malades atteints de GPA montre que les rechutes surviennent chez plus de la moitié des patients recevant un traitement prolongé et que le contrôle de l'affection nécessite un traitement long, dont la durée totale est parfois difficile à définir. Une des conséquences est la survenue d'effets secondaires fréquents et sévères. Hoffman et coll. ont démontré que le risque de survenue d'un cancer vésical était multiplié par 33, le risque de lymphome par 11, celui de tumeur solide par 2,4 avec les anciens protocoles prolongés de cyclophosphamide per os (2).
Le traitement des vascularites associées aux ANCA fait appel à un traitement initial d’induction dont l’objectif est la mise en rémission du patient qui est obtenue dans les 3 à 6 mois dans l’immense majorité des cas. Dès que celle-ci est obtenue, un traitement d’entretien moins toxique est alors débuté dont l’objectif est le maintien de cette rémission.
Traitement d’induction
Les corticoïdes
La dose initiale de corticoïdes est de 1 mg par kilo et par jour. Elle est parfois précédée d'un ou plusieurs bolus de méthylprednisolone (15 mg par kilo et par jour). Après un traitement initial de trois semaines, les corticoïdes doivent être diminués mais les habitudes thérapeutiques varient selon les médecins. En France, la tradition, plus que le résultat d'études contrôlées, consistait à traiter avec des doses relativement élevées de prednisone. Les études américaines visent à essayer de viser un sevrage cortisonique à 6 mois (19,20). Le groupe européen (EUVAS) recommande des doses et durées intermédiaires à celles employées dans les études américaines ou françaises (21).
Objectivement, les résultats cliniques sont comparables, quelque soit le mode de décroissance de la corticothérapie mais le risque iatrogène incite aujourd’hui à réduire au maximum les doses de corticoïdes. En pratique, il est souhaitable dès la fin du premier mois de réduire massivement la dose de corticoïdes puis de diminuer progressivement la posologie pour une durée totale de 18 à 24 mois de traitement. Les points de repère essentiels de la corticothérapie sont : environ 20 mg/j à 3 mois, 10 mg/j à 6 mois et 5 mg/j à un an (14).
L’étude PEXIVAS, essai randomisé contrôlé, a évalué une corticothérapie allégée en cas d’atteinte rénale ou d’hémorragie alvéolaire chez plus de 700 patients atteints de vascularite associée aux ANCA (en plus de l’évaluation des échanges plasmatiques). Cette étude a montré la non infériorité du bras allégé de corticoïdes pour le contrôle de la vascularite évalué sur un critère composite associant décès ou évolution vers l’insuffisance rénale définitive (22). Par contre, le taux d’infections sévères était significativement réduit à 1 an chez les patients ayant reçu une corticothérapie allégée. Depuis cette étude, on a tendance à diminuer encore la dose cumulative des corticoïdes, même si les résultats avec un plus grand recul sur le contrôle de la vascularite seront importants à considérer.
L'ostéoporose cortisonique doit être combattue par une activité physique régulière, une alimentation riche en calcium, une supplémentation vitamino-calcique et un bisphosphonate, d'autant plus que la masse osseuse est initialement basse.
Le cyclophosphamide représentait le traitement historique des GPA généralisées/diffuses
Le cyclophosphamide est utilisé en traitement d’induction, en association avec les corticoïdes. Le consensus sur ses modalités d'utilisation n'a pas été obtenu. La forme orale est prescrite à raison de 2 mg par kilo et par jour (2) et peut être adaptée à la réponse thérapeutique, à la survenue d'effets secondaires et à l'âge.
Les bolus de cyclophosphamide ont également été proposés (23,24). Les résultats obtenus sont comparables dans toutes les études. Elles démontrent que l'administration discontinue intraveineuse permet à court terme d'obtenir un résultat superposable à celui obtenu grâce au cyclophosphamide par voie orale (25). Néanmoins, la tolérance est meilleure par voie veineuse en rapport avec une moindre dose cumulative administrée. Dans notre expérience, le traitement par bolus est efficace et permet d'obtenir la rémission dans plus de 80 % des cas. Le nombre de rechutes à distance reste élevé et possiblement supérieur en cas d’utilisation par voie veineuse que par voie orale. La stratégie thérapeutique qu’il convient de développer doit donc être centrée sur les traitements de maintien de la rémission. Après 3 perfusions de cyclophosphamide à 15 jours d’intervalle de 0,6 g par mètre carré, nous recommandons l’administration toutes les trois semaines de 0,7 g par mètre carré jusqu’à obtention d’une rémission complète (14). Habituellement, 6 bolus sont nécessaires en 3 mois avant le relais par un traitement d’entretien.
Le méthotrexate est proposé dans les formes limitées/localisées de GPA
La dose hebdomadaire est de 0,3 mg/kg/semaine. Son efficacité est inférieure à celle du cyclophosphamide. Même si le méthotrexate est proposé pour diminuer les effets indésirables iatrogènes, il est également responsable d'effets secondaires : toxicité hépatique, pneumonie d'hypersensibilité, hypoplasie médullaire transitoire, etc.
En traitement d’induction ainsi que dans certaines rechutes, le méthotrexate représente une alternative au cyclophosphamide, en association à la corticothérapie, dans des formes de GPA ne mettant pas en jeu le pronostic vital. Des résultats encourageants avaient ainsi été rapportés dans des études ouvertes (26,27). La seule étude contrôlée a testé l’administration de 12 mois de méthotrexate ou de cyclophosphamide, en plus de la corticothérapie, chez des patients atteints de vascularite ANCA + sans atteinte vitale (28). A 6 mois, il n’a pas été noté de différence dans la fréquence de mise en rémission. Par contre, les patients ont rechuté plus souvent sous méthotrexate que sous cyclophosphamide. Cette étude confirme l’intérêt de ne pas interrompre l’immunosuppression à 12 mois et qu’un certain nombre de patients répondent au méthotrexate seul. Néanmoins, cette stratégie ne se conçoit que dans certaines GPA peu sévères initialement, à fonction rénale normale ou sub-normale, et avec une surveillance particulièrement attentive.
Le rituximab a bouleversé le traitement d’induction des formes réfractaires ou avec rechutes de la GPA et de la PAM sévère
En association avec la corticothérapie, cet anti-CD20 a bouleversé le traitement des GPA et PAM sévères, surtout des formes réfractaires ou avec rechutes. En effet, il représente une alternative efficace au cyclophosphamide des formes sévères. Il a obtenu une autorisation de mise sur le marché, au cours de la GPA ou MPA sévère, en association à la corticothérapie, en perfusions de 375 mg/m2 pendant 4 semaines consécutives. Les études ouvertes préliminaires concernaient des patients atteints de GPA réfractaires dans 3/4 des cas (29,30). Elles ont toutes été positives sauf une (31). Une mise en rémission complète a ainsi été rapportée chez 75-83 % des patients traités (29,30). Un délai de 3 mois est parfois nécessaire pour obtenir un effet thérapeutique maximal. Les patients atteints de granulomatose rétro-orbitaire ne répondent pas toujours ni ceux avec sténose sous glottique (29,31,32). Un traitement d’entretien est nécessaire après obtention d’une rémission par le rituximab. L’étude de la repopulation des cellules B et/ou de la réascension des ANCA ne suffit pour définir chez tous les patients le meilleur moment pour envisager un retraitement par le rituximab (29). Deux études prospectives multicentriques contrôlées ont comparé le rituximab au cyclophosphamide, en traitement d’induction, associé à une corticothérapie conventionnelle. Le taux de mise en rémission complète n’est pas moindre avec le rituximab qu’avec le traitement classique de cyclophosphamide avec un profil de tolérance comparable à court terme (19,33,34). Par contre, en cas de rechute, le rituximab est associé significativement à un meilleur taux de mise en rémission que le cyclophosphamide (34). Il doit donc être privilégié par rapport au cyclophosphamide en traitement d’induction des formes actives sévères chez les patients en rechute ou les femmes en âge de procréer. Une analyse post-hoc a montré que le rituximab serait plus efficace que le cyclophosphamide pour l’obtention d’une rémission chez les patients avec ANCA anti-PR3 (35). Il est également très intéressant dans les GPA réfractaires, en cas d’échec d’un traitement d’induction par le cyclophosphamide, où il permet l’obtention d’une rémission dans plus de la majorité des cas (36). Une prophylaxie contre la pneumocystose est indispensable.
Le mycophénolate mofétil
Il a fait l’objet d’une étude de non infériorité contre le cyclophosphamide en traitement d’induction des vascularites associées aux ANCA (37). Il n’y a pas eu moins de rémission à 6 mois chez les patients recevant le mycophénolate mofétil mais davantage de rechute ultérieure, surtout chez les patients avec ANCA anti-PR3. Il n’est donc pas utilisé en pratique chez les patients atteints de GPA.
Les anti-TNF ne sont pas utilisés
L’infliximab a parfois été utilisé en traitement d’attaque bref des GPA réfractaires, après échec d’un traitement conventionnel, sans immunosuppresseur associé. Une rémission est obtenue avec l’infliximab dans plus de 80 % des cas dans les études ouvertes ayant inclus au total 35 patients atteints de GPA en échec thérapeutique (30,38-40). Une étude pilote conduite par le GFEV a comparé le rituximab à l’infliximab dans ces formes de vascularite rebelles à plusieurs lignes d’immunosuppression, sans grande différence à court terme et sur de petits effectifs (41). Son efficacité n’est néanmoins que suspensive et il n’est plus utilisé.
Une étude contrôlée a aussi comparé l’étanercept à un placebo en plus du traitement conventionnel chez des patients atteints de GPA (20). Aucun bénéfice n’a été obtenu sous étanercept comme traitement d’entretien ni peut-être d’induction. Par contre, les patients ayant reçu l’etanercept en association avec le cyclophosphamide ont développé davantage de néoplasies solides que ceux ayant reçu le placebo. Il s’agissait de la première étude qui détectait une augmentation de l’incidence des cancers solides sous anti-TNF, posant la question de la potentialisation de l’effet carcinogène de l’immunosuppresseur, notamment dans cette maladie. La survenue de complications infectieuses sévères a aussi été rapportée sous l’association d’infliximab et de cyclophosphamide (42).
Traitements d’entretien
L'azathioprine était classiquement le traitement d'entretien de première intention. Il est efficace et bien toléré. Après obtention d’une rémission sous cyclophosphamide et corticoïdes, il n’y a pas plus de rechutes à 18 mois en cas de relais par l’azathioprine qu’en cas de poursuite du cyclophosphamide (21). L'azathioprine induit moins d'effets secondaires à long terme que le cyclophosphamide. La dose thérapeutique initiale est de 2 à 3 mg par kilo et par jour. Les rechutes restent fréquentes, en général après arrêt de l’azathioprine. Les rechutes sont moins fréquentes lorsque la durée du traitement immunosuppresseur « d’entretien » est de 4 ans après le diagnostic par rapport à un traitement d’entretien maintenu 2 ans (15).
Comme traitement d’entretien, le méthotrexate représente aussi une alternative classique après obtention d’une rémission (43-46). Le méthotrexate permet de maintenir la rémission dans plus de 80 % des cas (43) mais les rechutes après l’arrêt s’observent encore chez plus de la moitié des patients (45). Dans le seul essai randomisé contrôlé, l’azathioprine et le méthotrexate ont montré une efficacité comparable en traitement d’entretien pendant 12 mois, après mise en rémission obtenue par corticothérapie et bolus de cyclophosphamide, avec un sevrage de la corticothérapie à 29 mois (46). Les résultats sont aussi comparables après 10 ans de suivi (11).
Le rituximab s’est imposé comme le meilleur traitement d’entretien. Il a obtenu ne extension d’indication dans cette indication fin 2018 en Europe et aux USA sur les données de l’étude MAINRITSAN (47). Il est débuté à la mise en rémission, dans le mois suivant la dernière perfusion de cyclophosphamide ou 4 à 6 mois après le début du traitement d’induction par le rituximab. Administré à 500 mg à J1 et J15 puis tous les 6 mois pendant 18 mois (5 perfusions en 18 mois), il représente une véritable avancée thérapeutique. Dans une étude contrôlée, après mise en rémission par un traitement par le cyclophosphamide et la corticothérapie, il a permis de diviser par 6 la probabilité de rechute sévère au 28ème mois par rapport à un traitement d’entretien classique d’azathioprine poursuivi pendant 22 mois (47). La diminution du taux de rechute se maintient à 5 ans (17). Il a été montré qu’il était aussi possible d’administrer le rituximab uniquement en cas d’augmentation du titre des ANCA ou de repopulation des lymphocytes B sans majorer significativement le nombre de rechutes par rapport à une perfusion systématique semestrielle (48). Il est probable que la perfusion du J15 ne soit pas indispensable et que 4 perfusions en 18 mois suffisent (49). A moyen terme, dans la pratique, après un traitement d’induction par le rituximab, son efficacité et sa tolérance sont également très correctes au cours de la GPA : à deux ans du diagnostic ou de la rechute, le taux de survie sans rechute est de 85 % et le taux de maintien thérapeutique du rituximab est de 78 % (32).
Le leflunomide, le mycophénolate mofétil ou la deoxyspergualine ne sont pas prescrits en première intention. Ils ont été essayés chez un nombre limité de malades. Le mycophénolate mofétil s’est révélé moins efficace que l’azathioprine pour le maintien de la rémission au cours d’un essai contrôlé (50). Leur utilisation ne peut pas être recommandée en première intention. Dans ces cas de vascularite en rechute ou réfractaire, il est conseillé de discuter chaque observation avec les centres de référence et de compétences. Le centre de référence met aussi à disposition des informations actualisées sur les critères diagnostiques, les outils de suivi, les recommandations thérapeutiques et les protocoles en cours (www.vascularites.org).
Les immunoglobulines par voie intraveineuse ont été essentiellement employées chez les malades en rechute. Elles ont également été testées chez des patients non traités. Les résultats montrent une efficacité de ce traitement qui permet également d’obtenir une diminution du titre des ANCA. Néanmoins, un certain nombre de malades rechutent à l’arrêt des perfusions limitant l’intérêt de cette thérapeutique, qui est dans l'ensemble bien tolérée. Ce traitement peut être utile pour passer un cap chez certains patients avec une vascularite active et une sévère immunodépression. Les immunoglobulines sont administrées par voie intraveineuse à la dose de 2 g par kilo chaque mois. Nous recommandons une perfusion échelonnée sur 4 jours, d’autant plus que le malade souffre d'une insuffisance rénale.
Place des échanges plasmatiques
Ils étaient volontiers réalisés dans les formes sévères de vascularites associées aux ANCA avec insuffisance rénale rapidement progressive. Dans une étude européenne randomisée contrôlée, ils s’étaient montrés significativement supérieurs aux bolus de méthylprednisolone chez des patients avec une créatininémie initiale supérieure à 500 micromol/l pour diminuer le nombre de patients dialysés à 3 et 12 mois (51). Néanmoins, ils n’affectaient pas la survie globale et le bénéfice rénal ne se maintenait pas sur le long terme. L’étude PEXIVAS, essai randomisé contrôlé, évaluant en première intention l’intérêt des échanges plasmatiques en cas d’atteinte rénale ou d’hémorragie alvéolaire chez plus de 700 patients atteints de vascularite associée aux ANCA, n’a pas montré de bénéfice des échanges plasmatiques sur un critère composite associant décès ou évolution vers l’insuffisance rénale définitive (52). Depuis les résultats de cette étude, on a tendance à ne proposer les échanges que dans les formes sévères réfractaires à un traitement médical bien conduit (en seconde intention) ou en cas d’hémorragie alvéolaire massive.
Une hémorragie alvéolaire est habituellement traitée par l’association de corticoïdes et de cyclophosphamide ou de rituximab, voire d’échanges plasmatiques si elle est très importante ou en l’absence d’amélioration avec un traitement médical bien conduit.
Place du triméthoprime-sulfaméthoxazole
En plus de la prophylaxie des pneumocystoses et de l’éventuelle efficacité transitoire sur les formes localisées de GPA, le triméthoprime-sulfaméthoxazole aurait peut-être un rôle dans le maintien des rémissions. Dans une courte étude randomisée contrôlée en double insu, l'administration de 2 comprimés de BactrimÒ Forte pendant 2 ans a permis de diminuer de façon significative le taux de rechute par rapport à celle d'un placebo chez des patients en rémission complète (53). La réduction des rechutes était parallèle à la diminution de la fréquence des infections mais non corrélée au titre des ANCA.
Prévention et dépistage des complications thrombo-emboliques.
Elles doivent faire partie de la prise en charge initiale.
Dépistage et prise en charge des facteurs de risque cardio-vasculaire.
Il y a une augmentation de la fréquence des complications cardio-vasculaires au cours des vascularites associées aux ANCA nécessitant un dépistage et une prise en charge des facteurs de risque cardio-vasculaire associés (54,55).
Autres points de surveillance et de prise en charge
Sous traitement, un certain nombre d’effets secondaires peuvent survenir : infectieux à court terme, avec en particulier une pneumonie à Pneumocystis jirovecii, malin à long terme avec la survenue de cystopathies sous cyclophosphamide, de lymphomes et de tumeurs solides. La gravité de la maladie justifie cependant l’utilisation de traitements lourds.
La prophylaxie des infections est justifiée. Elle est indispensable contre la pneumocystose pulmonaire et fait appel au cotrimoxazole à la dose de 400 mg de sulfaméthoxazole par jour. Ce traitement pourrait avoir un intérêt pour diminuer globalement la fréquence des infections sévères sous rituximab (56). La prophylaxie des autres infections doit être adaptée au risque infectieux potentiel (contre la tuberculose, par exemple).
La surveillance régulière cutanée est importante car les patients avec une GPA développent davantage de cancers non mélaniques que des contrôles, possiblement en lien avec l’exposition prolongée aux immunosuppresseurs (57). Leur fréquence pourrait être moindre en cas d’utilisation du rituximab (58).
CONCLUSION
La GPA reste une maladie sévère, chronique, volontiers récidivante. Toutefois, grâce à un traitement adapté et prolongé, son pronostic s’est amélioré et le taux de survie de la maladie atteint 75 % à 10 ans. Un des problèmes thérapeutiques majeurs est lié à la survenue d’effets secondaires des traitements, dont la gravité et la fréquence sont souvent liées à une prolongation du traitement difficilement évitable.
A RETENIR
La granulomatose avec polyangéite (Wegener) (GPA) est une vascularite nécrosante associant une inflammation de la paroi vasculaire des vaisseaux de petit calibre et une granulomatose, péri- et extravasculaire.
Sur le plan clinique, elle se caractérise dans sa forme complète par des signes ORL, une atteinte pulmonaire et une atteinte rénale.
La GPA s'accompagne de la présence d'ANCA, de type cytoplasmique dans environ 90 % des formes diffuses et dans 50 % des formes localisées, qui sont dirigés contre la protéinase 3 dans l’immense majorité des cas. Les cANCA PR3 sont très spécifiques de la GPA et ont donc une importante valeur diagnostique.
Le traitement de la GPA repose sur l'association de corticoïdes et de cyclophosphamide ou de rituximab qui permet l’obtention de la rémission dans plus de 80 % des cas. L’azathioprine était le traitement d’entretien le plus utilisé mais le rituximab en entretien, à faible dose semestrielle, diminue davantage les rechutes avec une tolérance satisfaisante. Des rechutes à distance surviennent dans plus de 50 % des cas. Un des problèmes thérapeutiques majeurs est lié à la survenue d’effets secondaires des traitements, dont la gravité et la fréquence sont souvent liées à une prolongation du traitement difficilement évitable.
Dr Xavier Puéchal, Pr Loïc Guillevin
REFERENCES
- Millet A, Martin KR, Bonnefoy F, Saas P, Mocek J, Alkan M, et al.Proteinase 3 on apoptotic cells disrupts immune silencing in autoimmune vasculitis. J Clin Invest 2015 ; 125 : 4107-21.
- Hoffman GS, Kerr GS, Leavitt RY, Hallahan CW, Lebovics RS, Travis WD, et al. Wegener granulomatosis: an analysis of 158 patients. Ann Intern Med 1992 ; 116 : 488-98.
- Anderson G, Coles ET, Crane M, Douglas AC, Gibbs AR, Geddes DM, et al. Wegener's granuloma. A series of 265 British cases seen between 1975 and 1985. A report by a sub-committee of the British Thoracic Society Research Committee. Q J Med 1992 ; 83 : 427-38.
- Matteson EL, Gold KN, Bloch DA, Hunder GG. Long-term survival of patients with Wegener's granulomatosis from the American College of Rheumatology Wegener's Granulomatosis Classification Criteria Cohort. Am J Med 1996 ; 101 : 129-34.
- Guillevin L, Cordier JF, Lhote F, Cohen P, Jarrousse B, Royer I, et al. A prospective, multicenter, randomized trial comparing steroids and pulse cyclophosphamide versus steroids and oral cyclophosphamide in the treatment of generalized Wegener's granulomatosis. Arthritis Rheum 1997 ; 40 : 2187-98.
- Reinhold-Keller E, Beuge N, Latza U, De Groote K, Rudert H, Nölle B, et al. An interdisciplinary approach to the care of patients with Wegener's granulomatosis. Long-term outcome in 155 patients. Arthritis Rheum 2000 ; 43 : 1021-32.
- Iudici M, Pagnoux C, Courvoisier D, Cohen P, Hamidou M, Aouba A, et al, for the French Vasculitis Study Group : Granulomatosis with Polyangiitis: Data from the French Vasculitis Study Group Registry (abstract). Arthritis Rheumatol 2019; 71 (suppl 9): 1668.
- Mukhtyar C, Flossmann O, Hellmich B, et al. Outcomes from studies of antineutrophil cytoplasm antibody associated vasculitis: a systematic review by the European League Against Rheumatism systemic vasculitis task force. Ann Rheum Dis 2008 ; 67 : 1004-10.
- Boomsma MM, Stegeman CA, van der Leij MJ, et al. Prediction of relapses in Wegener's granulomatosis by measurement of antineutrophil cytoplasmic antibody levels: a prospective study. Arthritis Rheum 2000 ; 43 : 2025-33.
- Finkielman JD, Merkel PA, Schroeder D, et al. Antiproteinase 3 antineutrophil cytoplasmic antibodies and disease activity in Wegener granulomatosis. Ann Intern Med 2007 ; 147 : 611-9.
- Puéchal X, Pagnoux C, Perrodeau E, Hamidou M, Boffa JJ, Kyndt X et al. Long-term outcomes among participants in the WEGENT trial of remission-maintenance therapy for granulomatosis with polyangiitis (Wegener’s) or microscopic polyangiitis. Arthritis Rheumatol 2016 ; 68 : 690-701.
- Guillevin L, Lhote F, Gayraud M, et al. Prognostic factors in polyarteritis nodosa and Churg-Strauss syndrome. A prospective study in 342 patients. Medicine (Baltimore) 1996 ; 75: 17-28.
- Guillevin L, Pagnoux C, Seror R, Mahr A, Mouthon L, Toumelin PL for the French Vasculitis Study Group (FVSG). The Five-Factor Score Revisited: Assessment of Prognoses of Systemic Necrotizing Vasculitides Based on the French Vasculitis Study Group (FVSG) Cohort. Medicine (Baltimore) 2011 ; 90:19-27.
- Protocole National de Diagnostic et de Soins 2019. Vascularites nécrosantes systémiques (périartérite noueuse et vascularites associées aux ANCA). https://www.has-sante.fr/jcms/p_3076472/fr/vascularites-necrosantes-systemiques-periarterite-noueuse-et-vascularites-associees-aux-anca.
- Karras A, Pagnoux C, Haubitz M, de Groot K, Puéchal X, Cohen JW, et al. Randomised controlled trial of prolonged treatment in the remission phase of ANCA-associated vasculitis. Ann Rheum Dis 2017 ; 76 : 1662-8.
- Morgan MD, Szeto M, Walsh M, Jayne D, Westman K, Rasmussen N, et al. Negative anti-neutrophil cytoplasm antibody at switch to maintenance therapy is associated with a reduced risk of relapse. Arthritis Res Ther 2017 ; 7 ; 19 : 129.
- Terrier B, Pagnoux C, Perrodeau E, Karras A, Khouatra C, Aumaître O, et al, for the French Vasculitis Study Group. Long-term efficacy of remission-maintenance regimens for ANCA-associated vasculitides. Ann Rheum Dis 2018 ; 77 : 1150-6.
- Walton E. Giant-cell granuloma of respiratory tract (Wegener's granulomatosis). Br Med J 1958 ; 2 : 265.
- Stone JH, Merkel PA, Spiera R, Seo P, Langford CA, Hoffman GS et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med 2010 ; 363 : 221-32.
- The Wegener's Granulomatosis Etanercept Trial (WGET) Research Group : etanercept plus standard therapy for Wegener's granulomatosis. N Engl J Med 2005 ; 352 : 351-61.
- Jayne D, Rasmussen N, Andrassy K, Bacon P, Tervaert JW, Dadoniene J, et al. for the European Vasculitis Study Group : A randomized trial of maintenance therapy for vasculitis associated with antineutrophil cytoplasmic autoantibodies. N Engl J Med 2003 ; 349 : 36-44.
- Walsh M, Merkel PA, Peh CA, Szpirt WM, Puéchal X, Fujimoto S, et al. The effect of plasma exchange and reduced-dose oral glucocorticoids during induction of remission in patients with severe ANCA-associated vasculitis. N Engl J Med. 2020: sous presse.
- Nachman PH, Hogan SL, Jennette JC, Falk RJ. Treatment response and relapse in antineutrophil cytoplasmic autoantibody-associated microscopic polyangiitis and glomerulonephritis. J Am Soc Nephrol 1996 ; 7 : 33-9.
- Adu D, Pall A, Luqmani RA, Richards NT, Howie AJ, Emery P, et al. Controlled trial of pulse versus continuous prednisolone and cyclophosphamide in the treatment of systemic vasculitis. QJM 1997 ; 90 : 401-9.
- de Groot K, Harper L, Jayne DR, Flores Suarez LF, Gregorini G, Gross WL, et al for the European Vasculitis Study Group. Pulse versus daily oral cyclophosphamide for induction of remission in antineutrophil cytoplasmic antibody-associated vasculitis: a randomized trial. Ann Intern Med 2009 ; 150 : 670-80.
- Sneller MC, Hoffman GS, Talar-Williams C, Kerr GS, Hallahan CW, Fauci AS. An analysis of forty-two Wegener's granulomatosis patients treated with methotrexate and prednisone. Arthritis Rheum 1995 ; 38 : 608-13.
- Langford CA, Talar-Williams C, Sneller MC. Use of methotrexate and glucocorticoids in the treatment of Wegener's granulomatosis. Long-term renal outcome in patients with glomerulonephritis. Arthritis Rheum 2000 ; 43 : 1836-40.
- de Groot K, Rasmussen N, Bacon PA, Tervaert JW, Feighery C, Gregorini G, et al. Randomized trial of cyclophosphamide versus methotrexate for induction of remission in early systemic antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheum 2005 ; 52 : 2461-9.
- Jones RB, Ferraro AJ, Chaudhry AN, Brogan P, Salama AD, Smith KGC et al. A multicenter survey of rituximab therapy for refractory antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheum 2009 ; 60 : 2156-68.
- Puéchal X. Targeted immunotherapy strategies in ANCA-associated vasculitis. Joint Bone Spine 2019 ; 86 : 321-6.
- Aries PM, Hellmich B, Voswinkel J, Both M, Nolle B, Holl-Ulrich K, et al. Lack of efficacy of rituximab in Wegener's granulomatosis with refractory granulomatous manifestations. Ann Rheum Dis 2006 ; 65 : 853-8.
- Puéchal X, Iudici M, Calich AL, Vivot A, Terrier B, Regent A, et al, for the French Vasculitis Study Group: Rituximab for induction and maintenance therapy of granulomatosis with polyangiitis: a single-centre cohort study on 114 patients. Rheumatology 2019 ; 58 : 401-9.
- Jones RB, Cohen Tervaert JW, Hauser T, Luqmani R, Morgan MD, Peh CA et al. Rituximab versus cyclophosphamide in ANCA-associated renal vasculitis. N Engl J Med 2010 ; 363 : 211-20.
- 34. Specks U, Merkel PA, Seo P, Spiera R, Langford CA, Hoffman GS, et al for the RAVE-ITN Research Group. Efficacy of remission-induction regimens for ANCA-associated vasculitis. N Engl J Med 2013; 369: 417-27.
- Unizony S, Villarreal M, Miloslavsky EM, Lu N, Merkel PA, Spiera R, et al. Clinical outcomes of treatment of anti-neutrophil cytoplasmic antibody (ANCA)-associated vasculitis based on ANCA type. Ann Rheum Dis 2016 ; 75 : 1166-9.
- Miloslavsky EM, Specks U, Merkel PA, Seo P, Spiera R, Langford CA, et al for the Rituximab in ANCA-Associated Vasculitis-Immune Tolerance Network Research Group. Clinical outcomes of remission induction therapy for severe antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheum 2013 ; 65 : 2441-9.
- Jones RB, Hiemstra TF, Ballarin J, Blockmans DE, Brogan P, Bruchfeld A, et al for the European Vasculitis Study Group (EUVAS). Mycophenolate mofetil versus cyclophosphamide for remission induction in ANCA-associated vasculitis: a randomised, non-inferiority trial. Ann Rheum Dis 2019 ; 78 : 399-405.
- Bartolucci P, Ramanoelina J, Cohen P, Mahr A, Godmer P, Le Hello C,et al. Efficacy of the anti-TNF-alpha antibody infliximab against refractory systemic vasculitides: an open pilot study on 10 patients. Rheumatology 2002 ; 41 : 1126-32.
- Lamprecht P, Voswinkel J, Lilienthal T, Nolle B, Heller M, Gross WL, et al. Effectiveness of TNF-alpha blockade with infliximab in refractory Wegener's granulomatosis. Rheumatology 2002 ; 41 : 1303-7.
- Booth A, Harper L, Hammad T, Bacon P, Griffith M, Levy J et al. Prospective study of TNFalpha blockade with infliximab in anti-neutrophil cytoplasmic antibody-associated systemic vasculitis. J Am Soc Nephrol 2004 ; 15 : 717-21.
- de Menthon M, Cohen P, Pagnoux C, Buchler M, Sibilia J, Détrée F, et al. Infliximab or rituximab for refractory Wegener's granulomatosis: long-term follow up. A prospective randomised multicentre study on 17 patients. Clin Exp Rheumatol 2011 ; 29 (1 Suppl 64) : S63-71.
- Gause AM, Arbach O, Reinhold-Keller E, Voswinkel J, Lamprecht P, Gross WL. Induction of remission with infliximab in active generalized Wegener´s granulomatosis is effective but complicated by severe infections (abstract). Arthritis Rheum 2003 ; 9 (supplement) : S208.
- Langford CA, Talar-Williams C, Barron KS, Sneller MC. A staged approach to the treatment of Wegener's granulomatosis: induction of remission with glucocorticoids and daily cyclophosphamide switching to methotrexate for remission maintenance. Arthritis Rheum 1999 ; 42 : 2666-73.
- Reinhold-Keller E, Fink CO, Herlyn K, Gross WL, De Groot K. High rate of renal relapse in 71 patients with Wegener's granulomatosis under maintenance of remission with low-dose methotrexate. Arthritis Rheum 2002 ; 47 : 326-32.
- Langford CA, Talar-Williams C, Barron KS, Sneller MC. Use of a cyclophosphamide-induction methotrexate-maintenance regimen for the treatment of Wegener's granulomatosis: extended follow-up and rate of relapse. Am J Med 2003 ; 114 : 463-9.
- Pagnoux C, Mahr A, Hamidou MA, Boffa JJ, Ruivard M, Ducroix JP, et al for the French Vasculitis Study Group : Azathioprine or methotrexate maintenance for ANCA-associated vasculitis. N Engl J Med 2008 : 359:2790-2803.
- 47. Guillevin L, Pagnoux C, Karras A, Khoutra C, Aumaitre O, Cohen P, et al. Rituximab versus azathioprine for maintenance in ANCA-associated vasculitis. N Engl J Med 2014 : 371 : 1771-80.
- Charles P, Terrier B, Perrodeau E, Cohen P, Faguer S, Huart A, et al for the French Vasculitis Study Group : Comparison of individually tailored versus fixed-schedule rituximab regimen to maintain ANCA-associated vasculitis remission: Results of a multicentre, randomised controlled, phase III trial (MAINRITSAN2). Ann Rheum Dis 2018 ; 77 : 1143-9. Erratum in: Ann Rheum Dis 2019 ; 78 : e101.
- Charles P, Dechartres A, Terrier B, Cohen P, Faguer S, Huart A, et al for the French Vasculitis Study Group : Reducing the initial number of rituximab maintenance-therapy infusions for ANCA-associated vasculitides: randomised trial post-hoc analysis. Rheumatology 2019 : sous presse.
- Hiemstra TF, Walsh M, Mahr A, Savage CO, de Groot K, Harper L, et al. Mycophenolate mofetil vs azathioprine for remission maintenance in antineutrophil cytoplasmic antibody-associated vasculitis: a randomized controlled trial. JAMA 2010 ; 304 : 2381-8.
- Jayne DR, Gaskin G, Rasmussen R, Abramowicz D, Ferrario F, Guillevin L et al. Randomized trial of plasma exchange or high-dosage methylprednisolone as adjuctive therapy for severe renal vasculitis. J Am Soc Nephrol 2007 ; 18 : 2180-8.
- Walsh M, Merkel PA, Peh CA, Szpirt WM, Puéchal X, Fujimoto S, et al. The effect of plasma exchange and reduced-dose oral glucocorticoids during induction of remission in patients with severe ANCA-associated vasculitis. N Engl J Med. 2020: sous presse.
- Stegeman CA, Tervaert JW, de Jong PE, Kallenberg CG. Trimethoprim-sulfamethoxazole (co-trimoxazole) for the prevention of relapses of Wegener's granulomatosis for the Dutch Co-Trimoxazole Wegener Study Group. N Engl J Med 1996 ; 335 : 16-20.
- 54. Morgan MD, Turnbull J, Selamet U, Kaur-Hayer M, Nightingale P, Ferro CJ et al. Increased incidence of cardio-vascular events in patients with antineutrophil cytoplasmic antibody-associated vasculitides. Arthritis Rheum 2009 ; 60 : 3493-500.
- Terrier B, Chironi G, Pagnoux C, Cohen P, Puéchal X, Simon A, et al. Factors associated with major cardiovascular events in patients with systemic necrotizing vasculitides: results of a long-term follow-up study. J Rheumatol 2014 ; 41 : 723-9.
- Kronbichler A, Kerschbaum J, Gopaluni S, Tieu J, Alberici F, Jones RB, et al. Trimethoprim-sulfamethoxazole prophylaxis prevents severe/life-threatening infections following rituximab in antineutrophil cytoplasm antibody-associated vasculitis. Ann Rheum Dis 2018 ; 77 : 1440-7.
- Heijl C, Harper L, Flossmann O, Stücker I, Scott DG, Watts RA, et al. Incidence of malignancy in patients treated for ANCA-associated vasculitis : follow-up data from European Vasculitis Study Group clinical trials. Annals Rheum Dis 2011 ; 70: 1415-21.
- van Daalen EE, Rizzo R, Kronbichler A, Wolterbeek R, Bruijn JA, Jayne DR, et al. Effect of rituximab on malignancy risk in patients with ANCA-associated vasculitis. Ann Rheum Dis 2017 ; 76 : 1064-9.
Table I Caractéristiques de la granulomatose avec polyangéite (Wegener) selon les principales séries

Tableau II Facteurs pronostiques péjoratifs de la granulomatose avec polyangéite

CLICHE 1 Physiopathologie de la granulomatose avec polyangéite

CLICHE 2 ORL

CLICHE 3 nodule pulmonaire excavé

CLICHE 4 nodules pulmonaires

CLICHE 5 sténose bronchique

CLICHE 6 hémorragie alvéolaire

CLICHE 7 hémorragie alvéolaire au TDM

CLICHE 8 glomérulonéphrite extra-capillaire

Figure 1. Nomenclature révisée de la Conférence de Chapel Hill 2012

Figures 4. Nomenclature révisée de la Conférence de Chapel Hill 2012

Figure 7. ANCA

Figure 8. PNDS 2019 traitement des vascularites associées aux ANCA










